ปัจจัยที่มีผลต่อการทำงานของเอนไซม์
23968 จำนวนผู้เข้าชม |
อุณหภูมิ (Temperature)
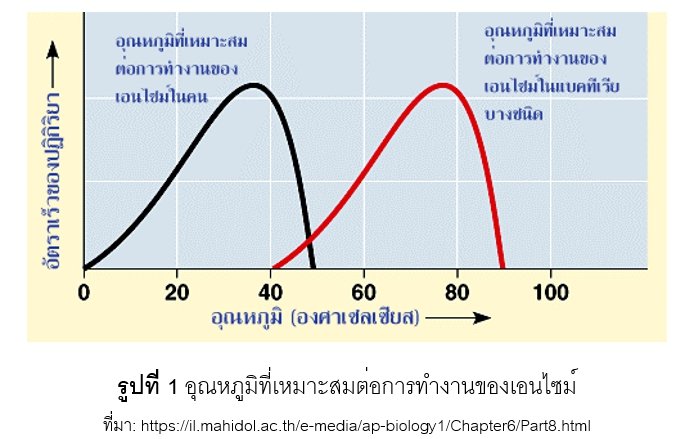
เอนไซม์แต่ละชนิดจะมีช่วงอุณหภูมิที่เหมาะสมต่อการทำงาน (optimal temperature) ที่แตกต่างกัน โดยทั่วไปอยู่ประมาณ 25 – 40 องศาเซลเซียส การเพิ่มอุณหภูมิจะทำให้พลังงานจลน์เพิ่มขึ้นส่งผลให้ปฏิกิริยาเคมีเกิดเพิ่มขึ้นด้วย แต่ถ้าอุณหภูมิสูงเกินไปจะทำให้ปฏิกิริยาเคมีเกิดลดลง ทั้งนี้เพราะเอนไซม์เกิดการสูญเสียสภาพ (denature) โดยความร้อนจะทำลายแรงยึดเหนี่ยวระหว่างพันธะไฮโดรเจนในโมเลกุลของเอนไซม์ ทำให้โครงรูปสามมิติของเอนไซม์เปลี่ยนแปลง ทำให้เอนไซม์ไม่สามารถเข้าจับกับ substrate ที่บริเวณ active site ได้ อย่างไรก็ตามถ้าอุณหภูมิต่ำเกินไปก็จะทำให้เอนไซม์มีอัตราการทำงานต่ำลง (enzyme freezing) ส่งผลให้ปฏิกิริยาเคมีเกิดขึ้นช้าลงด้วย
ในสิ่งมีชีวิตบางชนิดที่อยู่ในสิ่งแวดล้อมที่มีอุณหภูมิสูงมากได้ จะปรับสภาพพันธะเคมีภายในเอนไซม์เป็นพันธะ โควาเลนซ์เป็นหลัก ซึ่งทำให้ความร้อนทำลายแรงยึดเหนี่ยวได้ยากกว่าแรงยึดเหนี่ยวชนิดอื่น ๆ ส่งผลให้ค่า optimal temperature ของเอนไซม์จากสิ่งมีชีวิตเหล่านี้สูงกว่าสิ่งมีชีวิตทั่วไป ดังแสดงในรูปที่ 1
ค่าความเป็นกรดด่าง (pH)
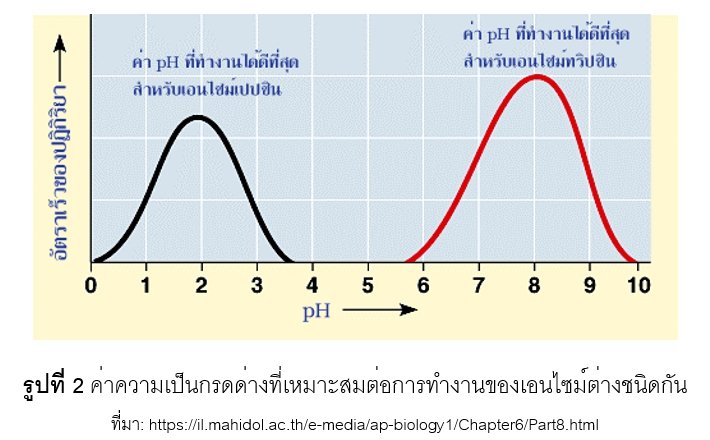
มีผลต่อการแตกตัวของหมู่โซ่ข้าง R-group ของกรดอะมิโนในโมเลกุลของเอนไซม์โดยค่า pH ที่เปลี่ยนแปลงมีผลทำให้ประจุของหมู่อะมิโน (-NH2) และหมู่คาร์บอกซิล (-COOH) ของกรดอะมิโนในเอนไซม์เปลี่ยนแปลง ส่งผลให้โครงรูปสามมิติของเอนไซม์เกิดการเปลี่ยนแปลงโดยเฉพาะบริเวณ active site ทำให้เอนไซม์เกิดการสูญเสียสภาพ (denature) เป็นผลให้ความสามารถของเอนไซม์ในการจับกับ substrate ที่บริเวณ active site ไม่สามารถเกิดขึ้นได้ เอนไซม์แต่ละชนิดมีค่า pH ที่เหมาะสม (optimum pH) ที่แตกกันออกไป ดังแสดงในรูปที่ 2 นอกจากนี้เอนไซม์ชนิดเดียวกันแต่มาจากสิ่งมีชีวิตที่แตกต่างกันก็มีค่า optimum pH ที่แตกต่างกันเช่นกัน ดังแสดงในตารางที่ 1

ความเข้มข้นของสารตั้งต้น (Substrate concentration)
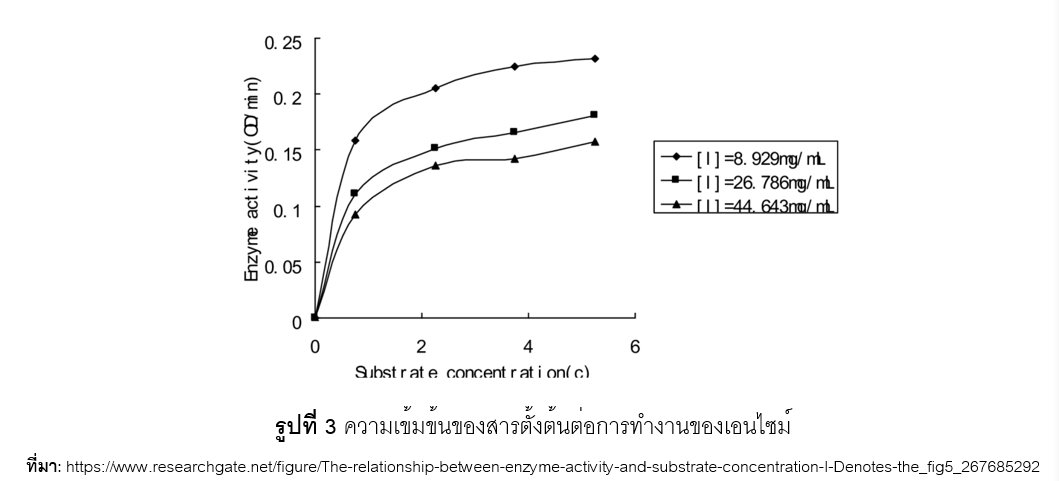
การเร่งปฏิกิริยาเคมีของเอนไซม์จะเกิดขึ้นเมื่อมีการจับกันของเอนไซม์และ substrate หากกำหนดให้มีปริมาณเอนไซม์คงที่และเพิ่มปริมาณ substrate ไปเรื่อย ๆ จะพบว่าอัตราการเกิดปฏิกิริยาเคมีมีลักษณะเป็นกราฟไฮเปอร์โบลาซึ่งแบ่งเป็น 3 ระยะคือ ระยะที่ 1 อัตราการเกิดปฏิกิริยาเคมีเป็นสัดส่วนโดยตรงต่อความเข้มข้นของ substrate ระยะที่ 2 อัตราการเกิดปฏิกิริยาเคมีเริ่มลดลงเนื่องจากปริมาณของเอนไซม์เริ่มจำกัด ระยะที่ 3 อัตราการเกิดปฏิกิริยาเคมีคงที่เพราะไม่มีปริมาณเอนไซม์ที่จะเข้าทำปฏิกิริยากับ substrate แล้ว ดังแสดงตามรูปที่ 3 โดยอัตราการเกิดปฏิกิริยาเคมีที่สูงที่สุดเรียกว่า ค่า Vmax
ความเข้มข้นของเอนไซม์ (Enzyme concentration)
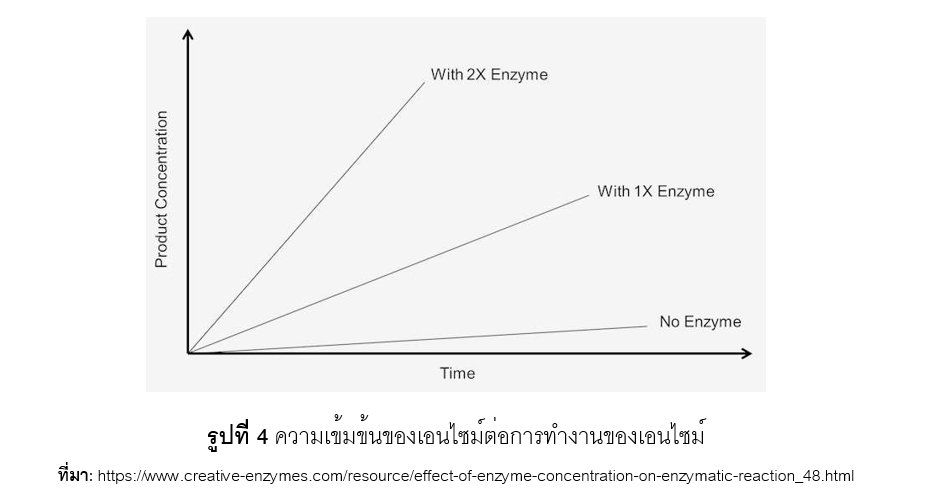
ถ้าเอนไซม์มีปริมาณมาก อัตราการเกิดปฏิกิริยาเคมีจะเกิดเร็วในช่วงต้น แต่หากใส่เอนไซม์มากเกินพอดี อัตราการเกิดของปฏิกิริยาก็จะไม่เพิ่มขึ้น ทั้งนี้เพราะไม่มี substrate เหลือพอที่จะเข้าทำปฏิกิริยา อัตราการเกิดปฏิกิริยาเคมีมีลักษณะเป็นกราฟเส้นตรง ดังแสดงในรูปที่ 4
สารยับยั้งการทำงานของเอนไซม์แบบย้อนกลับได้ (reversible inhibitor)
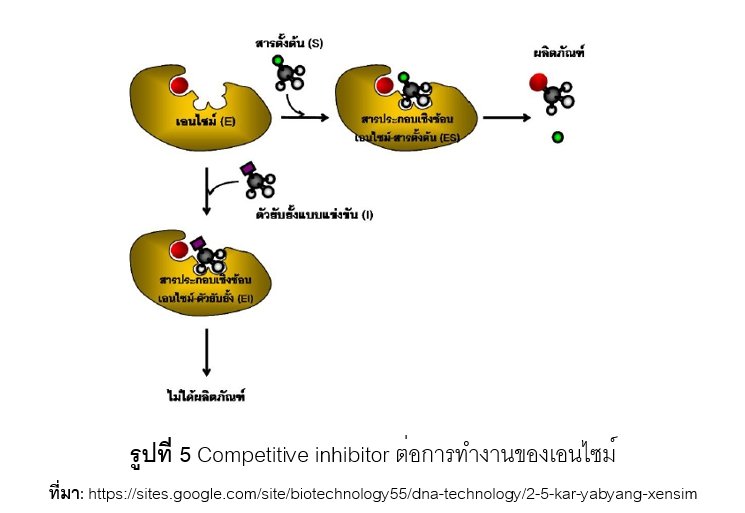
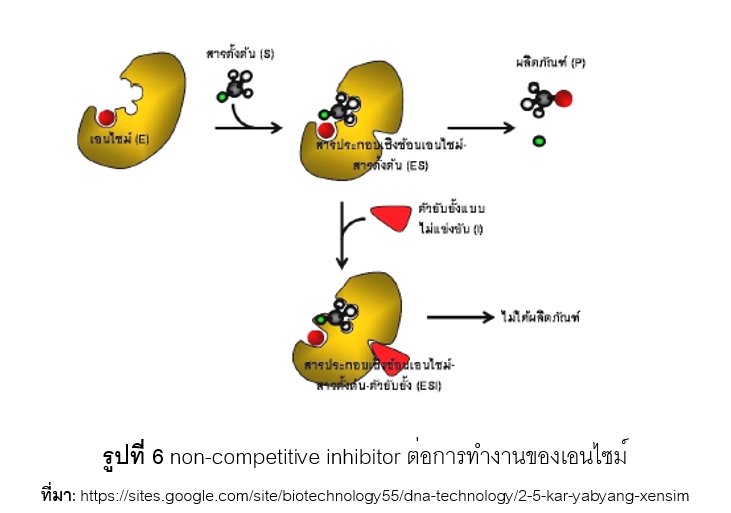
เมื่อเกิดการรวมกันของสารยับยั้งและเอนไซม์ (inhibitor enzyme complex) สารยับยั้งจะสร้างพันธะแบบชั่วคราวกับเอนไซม์ หากสารยับยั้งรวมกับเอนไซม์ที่บริเวณ active site จัดเป็นสารยับยั้งแบบแข่งขัน (competitive inhibitor) ซึ่งส่งผลให้เอนไซม์ตัวนั้นไม่สามารถไปจับกับ substrate ได้ปริมาณของเอนไซม์ที่สามารถเกิดปฏิกิริยาเคมีได้จึงมีลดลง อัตราการเกิดปฏิกิริยาเคมีระหว่างเอนไซม์กับ substrate จึงเกิดลดลง ดังแสดงในรูปที่ 5 อย่างไรก็ตาม competitive inhibitor สามารถแก้ไขได้โดยการเพิ่มความเข้มข้นของ substrate เพื่อลดโอกาสที่เอนไซม์จะรวมกับสารยับยั้งนั่นเอง หากสารยับยั้งรวมกับเอนไซม์ที่บริเวณอื่น ๆ จัดเป็นสารยับยั้งแบบไม่แข่งขัน (noncompetitive inhibitor) จะทำให้โครงรูปสามมิติของเอนไซม์เปลี่ยนแปลงไป ส่งผลให้ประสิทธิภาพในการเกิดอัตราปฏิกิริยาเคมีของเอนไซม์ลดต่ำลง ดังแสดงในรูปที่ 6 อย่างไรก็ตาม noncompetitive inhibitor ก็สามารถแก้ไขได้เช่นกัน โดยเติมสารที่สามารถจับกับ noncompetitive inhibitor เป็นต้น
สารยับยั้งการทำงานของเอนไซม์แบบย้อนกับไม่ได้ (irreversible inhibitor)
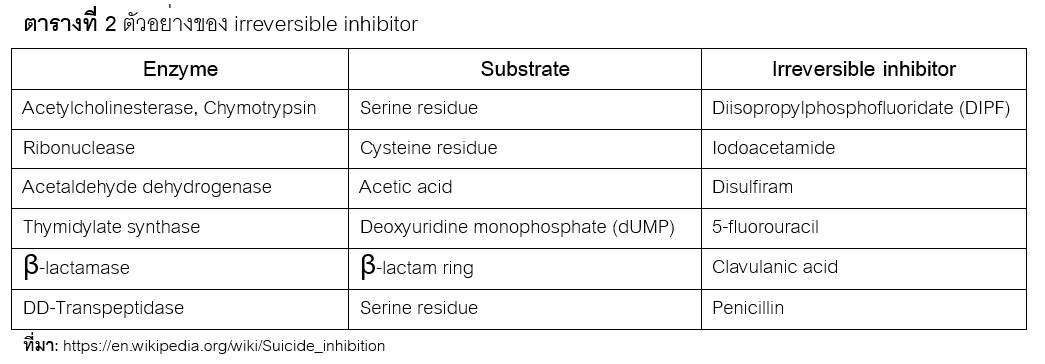
สารยับยั้งซึ่งมีโครงสร้างคล้ายกับ substrate (substrate analog) จะเข้าจับกับเอนไซม์ เกิดเป็น inhibitor enzyme complex สารยับยั้งจะสร้างพันธะโควาเลนท์แบบถาวรกับหมู่ –R group ของกรดอะมิโนในเอนไซม์ ทำให้การสลายตัวออกของ inhibitor enzyme complex เกิดได้ช้ามาก ส่งผลให้เอนไซม์ไม่สามารถทำงานได้ ปฏิกิริยาเคมีของเอนไซม์จึงไม่เกิดขึ้น ยกตัวอย่างของ irreversible inhibitor ดังแสดงในตารางที่ 2
แอกติวิตี้ของน้ำ (water activity)
เขียนย่อว่า aw น้ำเป็นตัวทำละลายที่ช่วยทำให้โมเลกุลของเอนไซม์และ substrate เคลื่อนที่ได้ดีจนสามารถจับตัวกันได้ซึ่งเอนไซม์ทั่วไปจะทำงานได้ดีเมื่ออยู่ในภาวะที่มีน้ำโดยเฉพาะเอนไซม์ใน Class 3 กลุ่ม Hydrolase ยกเว้นเอนไซม์บางชนิด เช่น ไรโบนิวเคลียเอส ไลโซไซม์ เป็นต้น ดังนั้นอัตราการเกิดปฏิกิริยาเคมีจึงเกิดได้ดี เมื่อมีค่า aw ค่อนข้างสูง



