คุณสมบัติและกลไกการทำงานของเอนไซม์
6967 จำนวนผู้เข้าชม |
คุณสมบัติของเอนไซม์
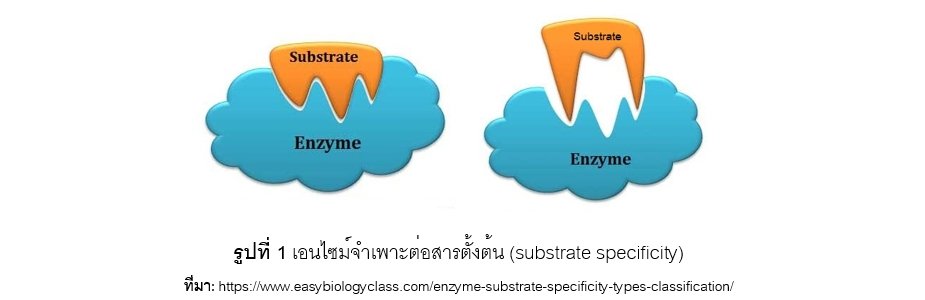
เอนไซม์แต่ละชนิดมีความจำเพาะต่อสารตั้งต้น (substrate specificity) โดยบริเวณเฉพาะบนโมเลกุลของเอนไซม์ที่จะจับกับสารตั้งต้นเรียกว่า “แหล่งกัมมันต์” (active site) ดังแสดงในรูปที่ 1 เช่น เอนไซม์แลกเทส (lactase) จะจำเพาะต่อน้ำตาลแลคโตส (lactose) ซึ่งเกิดจากน้ำตาลกาแลคโตส (galactose) เชื่อมต่อกับน้ำตาลกลูโคส (glucose) ด้วยพันธะเบต้า - 1,4 - ไกลโคซิดิก (b-1,4-glycosidic bond) เป็นต้น
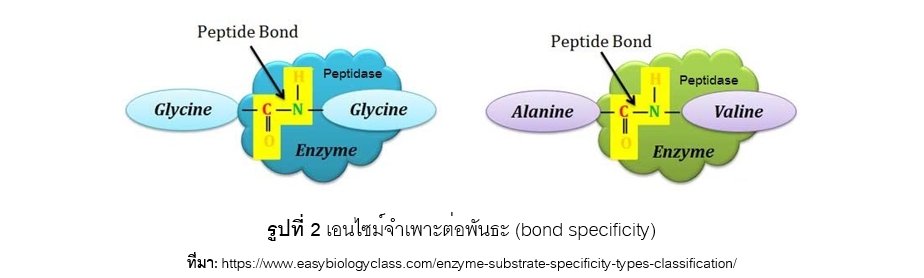
เอนไซม์แต่ละชนิดมีความจำเพาะต่อพันธะ (bond specificity) เช่น เอนไซม์เปปติเดส (peptidase) จำเพาะต่อพันธะเปปไทด์ (peptide bond) ระหว่างกรดอะมิโน (amino acid) ดังแสดงในรูปที่ 2
เอนไซม์แต่ละชนิดมีความจำเพาะต่อหมู่ที่จะย่อย (group specificity) เช่น เอนไซม์ไคโมทริปซิน (chymotripsin) จะจำเพาะต่อหมู่คาร์บอกซิล (carboxyl group) ของกรดอะมิโนที่มีวงแหวนอะโรมาติก (aromatic amino acid) เช่น Phenylalanine Tyrosine และ Tryptophan ดังแสดงในรูปที่ 3

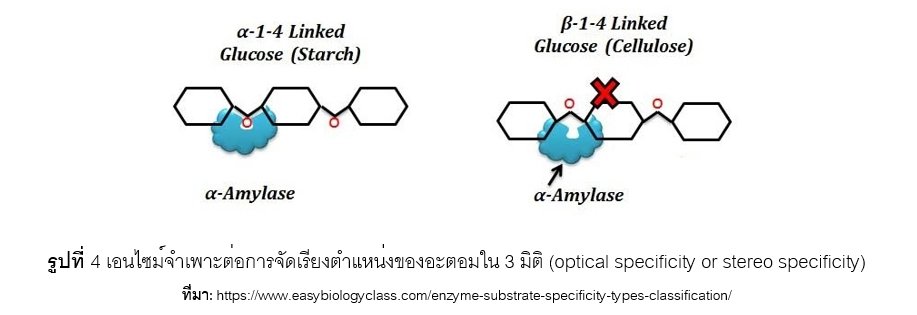
เอนไซม์แต่ละชนิดมีความจำเพาะต่อการจัดเรียงตำแหน่งของอะตอมใน 3 มิติ (optical specificity or stereo specificity) เช่น เอนไซม์อัลฟาอะไมเลส (a-amylase) จำเพาะต่อพันธะอัลฟาไกลโคซิดิก (a-glycosidic bond) ของแป้ง (strach) และไกลโคเจน (glycogen) ดังแสดงในรูปที่ 4
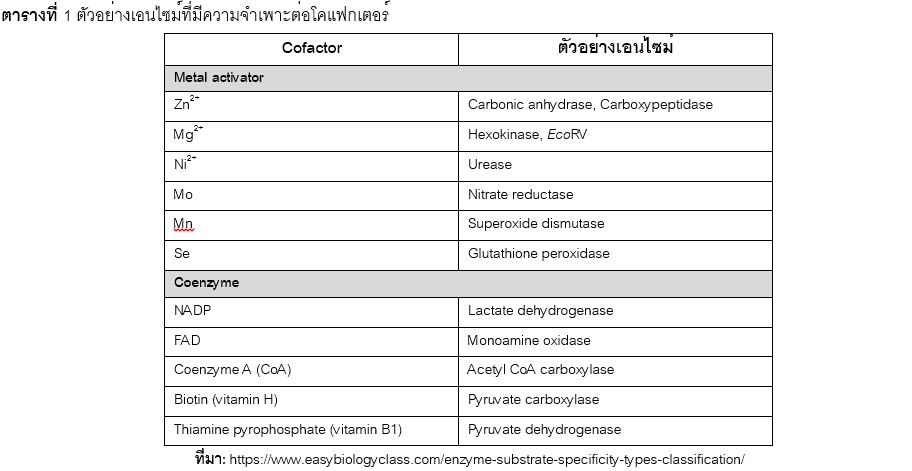
เอนไซม์บางชนิดมีความจำเพาะต่อโคแฟกเตอร์ (cofactor specificity) ดังแสดงตัวอย่างในตารางที่ 1
กลไกการทำงานของเอนไซม์
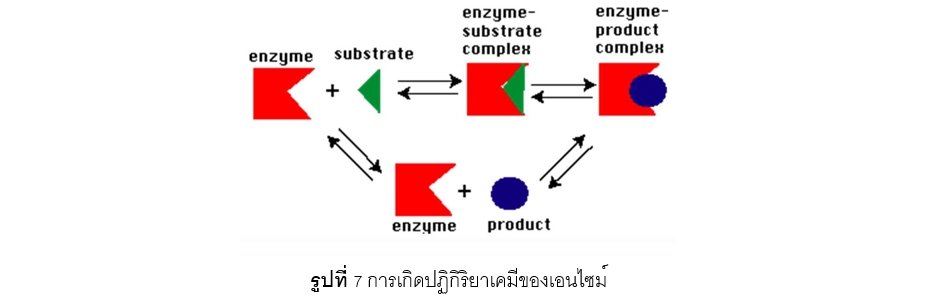
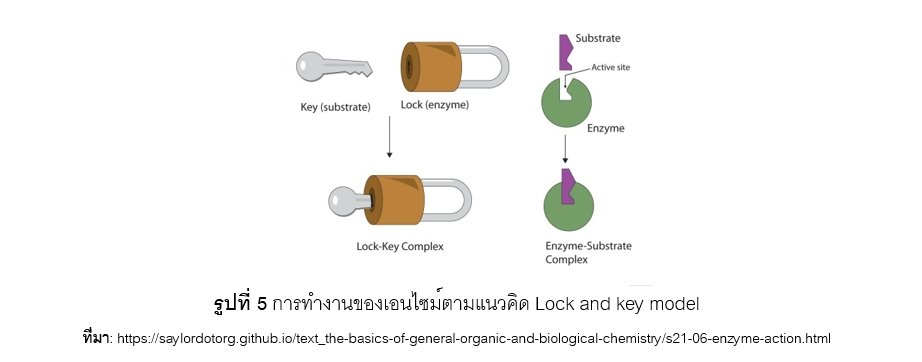
พ.ศ.2437 (ค.ศ.1894) Emil Fischer นักชีวเคมีเชื่อว่า เอนไซม์กับสารตั้งต้น (substrate) จะต้องมีรูปร่างที่สามารถจับกันได้พอดีที่บริเวณเฉพาะเจาะจง เมื่อเอนไซม์รวมกับ substrate ที่เหมาะสมแล้วจะเกิดเป็นสารเชิงซ้อนที่เรียกว่า “เอนไซม์ ซับสเตรตเชิงซ้อน” (enzyme substrate complex) ซึ่งจับกันไว้ด้วยพันธะไฮโดรเจน หรือ พันธะไอออนิก หรือ พันธะโควาเลนท์ หลังจากนั้น เอนไซม์ซับสเตรตเชิงซ้อนจะแยกตัวออกจากกันและทำให้เกิดสารผลปฏิกิริยา (product) และเอนไซม์อิสระกลับคืนมา ตามแนวคิดของทฤษฎีแม่กุญแจและลูกกุญแจ (Lock and key model) เปรียบเทียบการทำงานของเอนไซม์และ substrate เหมือนแม่กุญแจกับลูกกุญแจ ดังแสดงในรูปที่ 5
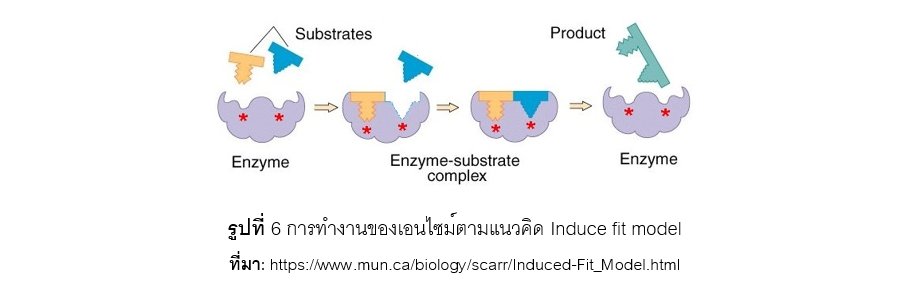
เมื่อ พ.ศ.2501 (ค.ศ.1958) Koshland พบว่าโครงสร้างของ substrate และเอนไซม์มีความแตกต่างกันเล็กน้อย ไม่ได้เข้ากันได้ทุกประการ แต่เมื่อจะมีการรวมตัวกันเอนไซม์จะมีการเปลี่ยนแปลงโครงสร้างสามมิติไปเล็กน้อยเพื่อให้สามารถจับกับ substrate ได้ตามแนวคิดของทฤษฎีเหนี่ยวนำให้เหมาะสม (Induce fit model) เปรียบเทียบคล้ายกับถุงมือที่ถูกสวมใส่ลงในมือทำให้เกิดเป็นรูปร่างเหมือนมือได้ ดังแสดงในรูปที่ 6
การเสื่อมสภาพของเอนไซม์ (Denaturation)
เมื่อโครงสร้างของเอนไซม์เปลี่ยนไปจนสารตั้งต้น (substrate) รวมกับเอนไซม์ที่บริเวณ active site ไม่ได้ ส่งผลให้คุณสมบัติในการเร่งปฏิกิริยาเคมีของเอนไซม์หมดไป ไม่สามารถจะกลับคืนมาสู่สภาพที่พร้อมทำงานได้อีก เรียกว่า เอนไซม์เกิดการเสื่อมสภาพไปแล้ว โดยสิ่งที่สามารถทำให้เอนไซม์เสื่อมสภาพ ได้แก่ โลหะหนัก (Ag+ Hg+ และ Pb+) สารรีดิวซ์ ออกซิเจน สารออกซิไดซ์ อุณหภูมิสูงในสภาพที่แห้ง เป็นต้น ปฏิกิริยาเคมีจะยังคงสามารถเกิดขึ้นอย่างต่อเนื่องไปได้เรื่อย ๆ หากเอนไซม์ไม่สูญเสียสภาพ ดังแสดงในรูปที่ 7